date:2025-11-28 11:40:53
更智能的成像:當AI遇見自動化細胞顯微鏡技術
近年來,自動化與人工智能的結合徹底改變了細胞成像領域。自動化技術的到來率先改變了成像的日常實踐,它通過自動化重復性工作并大規模標準化采集過程,從而重塑了細胞成像。例如,自動化載物臺能夠可靠地對數百個孔板進行聚焦;采集軟件能在不同孔板之間應用一致的曝光和照明設置;培養系統能維持穩定的溫度和CO?濃度,使活細胞能夠自然生長。這些自動化技術的應用,帶來了更清晰、可重復的圖像,顯著減少了人工操作和變異的來源。
隨后,人工智能(AI)成為下一個重要的技術層。它通過檢測細胞和細胞器,并測量跨通道和時間序列中的強度、紋理、形狀及運動,將海量圖像數據轉化為定量的分析結果。機器學習,尤其是深度學習的最新進展,使得模型能夠識別簡單和復雜成像數據中隱藏的細微結構[1]。深度學習模型可以直接從數據中學習表型,區分健康與應激細胞,根據化合物的效果進行分組,并識別肉眼難以察覺的表面模式。其帶來的巨大優勢在于速度、客觀性和深度,模型能夠對每一幀圖像應用相同的評判標準。
自動化和人工智能共同催生了一種新的顯微鏡技術,即高內涵成像 (High-Content Imaging)。通過結合自動化采集和智能分析,研究人員能夠超越簡單的快照式觀察,生成豐富、多維的數據集,從而描述細胞的行為、相互作用以及它們如何響應周圍環境[2]。
何為高內涵成像?
高內涵成像(High-Content Imaging,HCI)將自動化和人工智能在一個單一工作流程中結合起來。自動化顯微鏡跨越多個孔板捕獲數千張圖像,而分析管道則從每個孔中的每個細胞提取詳細信息。HCI不依賴于單一的檢測指標,而是測量廣泛的參數,包括形態、熒光強度、蛋白質定位和細胞器行為。
由于工作流程是自動化的,每個孔板都在一致的條件下進行成像。先進的軟件可以維持焦點、曝光和照明,確保生成的數據集既可重復又可比較。現代自動化顯微鏡配備了熒光和共聚焦成像功能,結合AI分析軟件,能夠提高表型分析的通量和準確性,使大規模篩選比以往任何時候都更快、更可靠[3]。其最終結果是一個精確的表型圖譜,能夠捕捉細胞如何跨越空間和時間對藥物、刺激或基因變化做出響應。

圖1 | 高內涵成像實驗示意圖
為了支持這一工作流程,成像級的實驗室耗材起著至關重要的作用。ibidi的 µ-Plate 96 Well 3D, µ-Plate 96 Well Square, µ-Plate 96 Well Round, 和µ-Plate 384 Well Glass Bottom專為高通量顯微鏡而設計。其#1.5 Polymer聚合物或#1.5H Glass玻璃蓋玻片底部為熒光和共聚焦成像提供了所需的光學清晰度,而黑色壁的設計則最大限度地減少了孔間串擾。這些特性確保了所捕獲的每張圖像在質量上都保持一致,并為基于AI的分析做好準備。

自動化與人工智能的協同優勢
自動化與人工智能結合的強大之處在于二者的互補性:自動化生成海量、一致性的數據集,人工智能從中提取意義。二者協同可加速科學發現,提高實驗的可重復性,并拓展可測量內容的邊界。
規模與速度
自動化成像系統可以在幾分鐘內處理整塊多孔板,在無人干預的情況下捕獲數千張圖像。某些設置甚至能在短短兩小時內完成四十塊96孔板的成像。這種規模使得研究人員能夠探索完整的化合物庫、進行大規模基因篩選或開展手動實驗無法完成的延時實驗。自動化使高通量成像既高效又常規化,讓研究人員能夠將精力集中在數據解讀而非圖像采集上。
洞察深度
人工智能從每張圖像中提取數百個參數,揭示隨時間演變的細微形態或分子變化。深度學習(尤其是卷積神經網絡 (CNNs))已成為圖像分析的基石[4]。這些模型能直接從數據中學習表型特征,識別健康細胞與應激細胞的差異,根據表型特征分類化合物效應,并發現肉眼不可見的新細胞狀態[5]。一旦模型訓練完成,同一模型可在數分鐘內分析新數據集,完成人類分析師需耗時數日甚至數周的工作。這使顯微鏡從描述性工具蛻變為理解細胞行為的豐富、定量平臺。
可重復性與客觀性
自動化確保成像條件完全一致。人工智能對每幀圖像應用相同的客觀規則,從而減少偏差并提升跨培養板、儀器及地點的可重復性。這種一致性對大規模、多中心實驗至關重要,有助于將成像技術真正轉化為一門定量學科。
與3D模型的兼容性
隨著生物學向更逼真的模型發展,人工智能與自動化技術使3D球體、類器官及共培養體系的研究精度可媲美2D系統[6][7]。自動化顯微鏡能穿透厚樣本保持聚焦,人工智能算法則可隨時間推移重建并量化3D結構(圖2a)。在患者來源類器官研究中,高內涵成像結合人工智能技術已能預測個體腫瘤對特定藥物的反應,為數據驅動的精準醫療鋪平道路[8]。

ibidi µ-Plate 96 Well 3D 96孔3D培養板支持均勻的球體形成和長時程穩定成像,為復雜模型的定量高內涵成像提供可靠平臺。
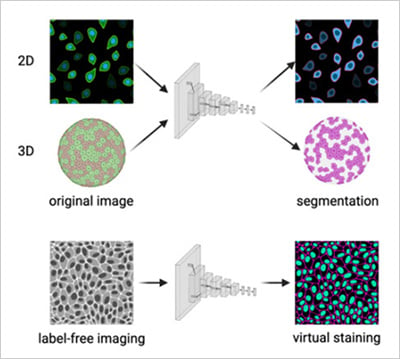
圖2 | a) 卷積神經網絡對2D與3D顯微數據集進行細胞分割。b) 卷積神經網絡從無標記明場圖像預測熒光通道(虛擬染色)。改編自Carreras-Puigvert, J., et al., 2024[11]。
新發現與預測性洞察
人工智能檢測細微模式的能力催生了新型生物學發現。深度學習可按作用機制對化合物進行分組,揭示脫靶效應,并識別疾病早期標志物。在活細胞成像中,人工智能現可實時追蹤細胞運動、分裂及形態變化,揭示細胞如何動態響應藥物或基因擾動。這使延時成像成為高內涵篩選的核心組件,為細胞響應動力學研究提供關鍵洞察[9][10]。
為保障長期活細胞實驗的穩定性與可重復性,ibidi Stage Top Incubators(載物臺培養箱/活細胞工作站)可在顯微鏡載物臺上直接精準控制溫度、濕度、CO?及O?濃度。該技術確保細胞在長期延時研究中保持最佳健康狀態與恒定成像條件。
與此同時,新型生成式人工智能模型正被用于預測分析,能夠模擬細胞反應,或基于現有成像數據提出新的實驗條件(圖2b)。

智能成像的未來
人工智能、自動化與先進顯微技術的融合,正在重塑科學家從圖像中獲取知識的邊界。不久的將來,人工智能不僅能分析數據,更能實時引導顯微鏡操作——自動調節焦距、識別關鍵事件,或在必要時觸發更高分辨率的成像。
貫穿樣本制備、圖像采集、分析與可視化的全流程成像管道已初現雛形。隨著技術持續進步,更快速、更精準、更具預測性的成像,使研究者能夠以前所未有的深度和規模來測量與解讀細胞過程。

對科學家而言,這意味著將花費更少的時間在重復性工作上,而將更多的時間用于解讀生物學數據。而對于細胞成像本身而言,這標志著它正從僅僅“觀察生命”轉向借助自動化和人工智能的聯合力量來“理解生命”。
參考文獻
[1] Wong, F., et al., Discovery of a structural class of antibiotics with explainable deep learning. Nature, 2024. 626(7997): p. 177-185.
[2] Way, G.P., et al., Evolution and impact of high content imaging. SLAS Discovery, 2023. 28(7): p. 292-305.
[3] Kupczyk, E., et al., Unleashing high content screening in hit detection – Benchmarking AI workflows including novelty detection. Computational and Structural Biotechnology Journal, 2022. 20: p. 5453-5465.
[4] Gupta, A., et al., Deep Learning in Image Cytometry: A Review. Cytometry Part A, 2019. 95(4): p. 366-380.
[5] Pachitariu, M. and C. Stringer, Cellpose 2.0: how to train your own model. Nature Methods, 2022. 19(12): p. 1634-1641.
[6] Choo, N., et al., High-Throughput Imaging Assay for Drug Screening of 3D Prostate Cancer Organoids. SLAS Discovery, 2021. 26(9): p. 1107-1124.
[7] Betge, J., et al., The drug-induced phenotypic landscape of colorectal cancer organoids. Nature Communications, 2022. 13(1): p. 3135.
[8] Jiménez-Luna, J., et al., Artificial intelligence in drug discovery: recent advances and future perspectives. Expert Opinion on Drug Discovery, 2021. 16(9): p. 949-959.
[9] Yang, X., et al., A live-cell image-based machine learning strategy for reducing variability in PSC differentiation systems. Cell Discovery, 2023. 9(1): p. 53.
[10] Wiggins, L., et al., The CellPhe toolkit for cell phenotyping using time-lapse imaging and pattern recognition. Nature Communications, 2023. 14(1): p. 1854.
[11] Carreras-Puigvert, J. and O. Spjuth, Artificial intelligence for high content imaging in drug discovery. Current Opinion in Structural Biology, 2024. 87: 102842.
ICP備案號:
滬ICP備15057650號-1
 滬公網安備31011202005471
滬公網安備31011202005471
雷萌生物科技(上海)有限公司 保留所有版權.